Piezoelektrisches kaltes atmosphärisches Plasma induziert Apoptose und Autophagie
in menschlichen hepatozellulären Karzinomzellen durch Blockierung der Glykolyse und des AKT/mTOR/HIF-1α-Wegs
Autoren: Yanhong Wang, Xinyu Mang, Danni Li, Yiliang Chen, Zhenyu Cai, Fei Tan
Datum: 1 November 2023
Zuerst veröffentlicht auf: https://www.sciencedirect.com/science/article/pii/S0891584923005701?via%3Dihub
Abstract
Das hepatozelluläre Karzinom (HCC) ist die sechsthäufigste Krebsart und die vierthäufigste krebsbedingte Todesursache weltweit. Das fortgeschrittene oder metastasierte HCC wird derzeit mit systemischen Medikamenten behandelt, wobei die Überlebensrate der Patienten unbefriedigend ist. Kaltes Atmosphärenplasma hat sich als vielversprechende, physikalisch-chemische Onkotherapie mit breitem Wirkungsspektrum erwiesen. In dieser präklinischen Studie untersuchten wir die antineoplastischen Funktionen und den Mechanismus des auf piezoelektrischer Direktentladungstechnologie basierenden CAP, Piezo-CAP, bei HCC in vitro und in vivo. Verschiedene HCC-Zelllinien wie SMMC7721, HepG2 und LM3 wurden als In-vitro-Krebsmodell für die phänotypischen und mechanistischen Studien verwendet.
Einführung
Kaltes atmosphärisches Plasma (CAP) wurde vor kurzem als physikochemische antineoplastische Therapie anerkannt. Als vierter Aggregatzustand ist CAP ein teilweise ionisiertes und nichtthermisches Gasgemisch, das bei Raumtemperatur und Umgebungsdruck erzeugt wird. Die Plasma-Onkologie, d.h. die Anwendung von CAP zur Tumorbehandlung, hat zusammen mit den erfolgreichen Anwendungen von CAP in anderen medizinischen und chirurgischen Fachgebieten großes Interesse geweckt. Die Grundlage der Plasma-Onkologie beruht auf der internen Verwundbarkeit durch ein Redox-Ungleichgewicht, d. h. abnorm erhöhte krebszelluläre reaktive Sauerstoffspezies (ROS), und dem externen Targeting durch die vorherrschende Komponente von CAP, d. h. reaktive Sauerstoff- und Stickstoffspezies (RONS). Neben diesen chemischen Faktoren könnten auch andere physikalische Bestandteile von CAP, wie thermische Entladung, ultraviolette Strahlung und elektromagnetische Wellen, den Tod von Krebszellen auslösen, was die Rolle von CAP als physikalisch-chemische Anti-Krebs-Behandlung noch komplexer macht.
Piezo-CAP hemmt die Proliferation von HCC-Zellen
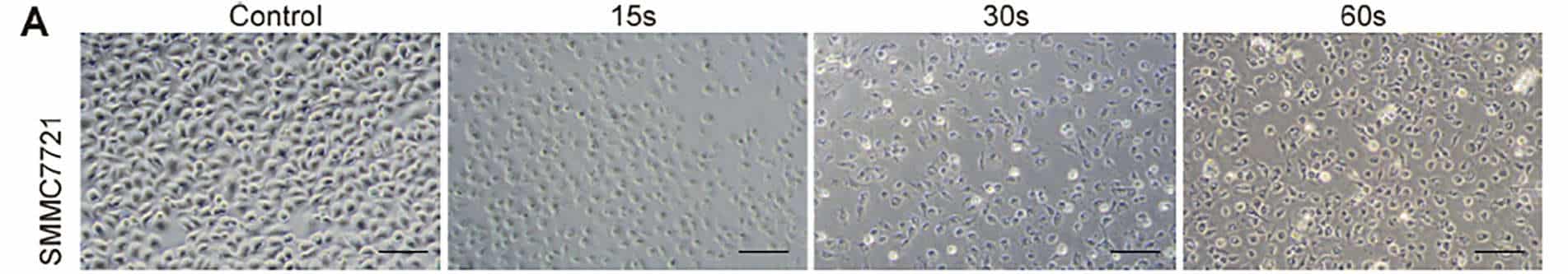
Um die universelle Wirkung von Piezo-CAP auf die Proliferation verschiedener Arten von HCC-Zellen zu untersuchen, wurden exponentiell wachsende SMMC7721-, HepG2- und LM3-Zellen mit zunehmender Dauer des Plasmas (von 5 s bis 90 s) behandelt. Unter dem Phasenkontrastmikroskop zeigte sich eine deutliche Veränderung der Morphologie und Zelldichte der getesteten HCC-Zellen (Abb. 2A). Alle Zellen waren deutlich geschrumpft und hafteten weniger an der Zellkulturschale, nachdem sie 30 Sekunden lang mit Piezo-CAP behandelt worden waren. Wurde die Behandlungsdauer verdoppelt, wurden die Zellen kugelförmig, schrumpften und schwebten visuell im Zellkulturmedium, was auf eine stärkere Ablösung der Zellen hindeutet.
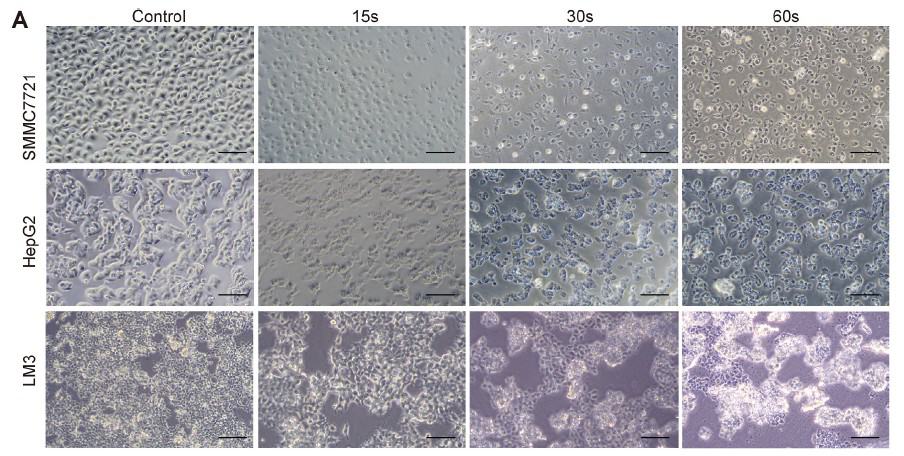
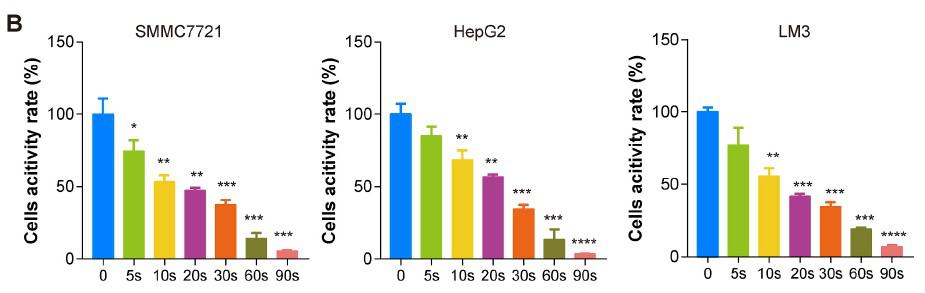
Darüber hinaus wurde die Wirkung von Piezo-CAP auf die Zellproliferation mit Hilfe des CCK-8-Tests (Abb. 2B) und des Koloniebildungstests (Abb. 2C und D) quantitativ bestätigt. Piezo-CAP hemmte signifikant die Proliferation aller getesteten HCC-Zellen im Vergleich zur Kontrolle (P < 0,01). Die IC50-Werte von SMMC7721-, HepG2- und LM3-Zellen nach Piezo-CAP-Behandlung lagen bei 19,73, 22,81 bzw. 19,47.
Zusammenfassung
In dieser präklinischen Studie sind wir die ersten, die systematisch die starke krebshemmende Wirkung von piezoelektrischem kaltem atmosphärischem Plasma auf das menschliche Leberzellkarzinom und den zugrunde liegenden molekularen Mechanismus nachweisen. Unter Verwendung verschiedener In-vitro-Modelle (SMMC7721, HepG2 und LM3 HCC-Zellen) und In-vivo-Modelle (CDX-Mäuse) haben wir zunächst festgestellt, dass Piezo-CAP Antitumorfunktionen ausübt, indem es verschiedene Krebsmerkmale wie Zellproliferation, Migration und Invasion, EMT und antioxidative Abwehr hemmt. Weitere phänotypische und mechanistische Studien ergaben, dass Piezo-CAP eine zweigleisige Anti-Krebs-Strategie verfolgt: Es induziert den Tod von Krebszellen und stört das Überleben von Krebszellen. Ersteres wird durch den plasmainduzierten, vielgestaltigen programmierten Zelltod, z. B. Apoptose und Autophagie, veranschaulicht, während letzteres durch die durch das Plasma abgeschwächten Überlebensmechanismen, z. B. Tumorglykolyse und onkogene Proliferation, zum Ausdruck kommt.
Mit Hilfe der bioinformatischen Analyse entdeckten und verifizierten wir zahlreiche Signalwege, die empfindlich auf die Piezo-CAP-Behandlung von HCC reagieren, wie der Oxidations-Reduktionsweg von GSH, der E-Cadherin/N-Cadherin-Schalter von EMT, der mitochondriale apoptotische Weg, der glykolytische Weg und der PI3K/Akt/mTOR/HIF-Weg. Am wichtigsten ist, dass Piezo-CAP die oben genannten Anti-HCC-Funktionen mit außergewöhnlicher Energieeffizienz, Kompaktheit und Vielseitigkeit und ohne zusätzlichen Gasbedarf (außer Umgebungsluft) erreicht. Zusammenfassend lässt sich sagen, dass Piezo-CAP eine vielversprechende, ergänzende physikalisch-chemische Anti-HCC-Therapie darstellt. Auf der Grundlage der transkriptomischen, proteinhaltigen, zellulären und tierexperimentellen Daten aus dieser Studie wäre der ideale nächste Schritt die Vorbereitung auf klinische Studien am Menschen.
Den ganzen Fachartikel Piezoelektrisches kaltes atmosphärisches Plasma induziert Apoptose und Autophagie können Sie hier lesen.